Tellurium tetrafluoride.
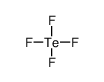
Tellurium tetrafluoride.结构式

|
常用名 | Tellurium tetrafluoride. | 英文名 | Tellurium tetrafluoride. |
|---|---|---|---|---|
| CAS号 | 15192-26-4 | 分子量 | 203.59400 | |
| 密度 | N/A | 沸点 | N/A | |
| 分子式 | F4Te | 熔点 | N/A | |
| MSDS | N/A | 闪点 | N/A |
| 英文名 | tellurium(IV) tetrafluoride |
|---|---|
| 英文别名 | 更多 |
| 分子式 | F4Te |
|---|---|
| 分子量 | 203.59400 |
| 精确质量 | 205.90000 |
| LogP | 1.30000 |
| 更多 | 1.性状:白色吸湿性固体,结晶属正交晶系,其蒸气易分解为TeF6和Te。TeF4遇水迅速水解生成H2TeO3和HF。 2.熔点(℃):129.7。 3.沸点(℃):193.9。 |
| Tellurium tetrafluoride.上游产品 0 | |
|---|---|
| Tellurium tetrafluoride.下游产品 5 | |
制法1 用四氟化硫与二氧化碲反应可制得四氟化碲:
TeO2+2SF4=TeF4+2SOF2
将16g二氧化碲放在高压容器中,并将其冷冻到液氮温度,通过真空管路使43g四氟化硫在高压容器中凝聚。然后将高压容器加热,在130℃下反应8h,此时容器内的压力约为6MPa。当容器冷却到室温后,通过一高效的通风橱将容器中的所有气体物质(过量的SF4和生成的SOF2)排放掉。在无水条件下将高压容器中的晶状残留物转移到升华器中,在100℃和1.33Pa的条件下进行升华,即可得到纯净的TeF4。应注意SF4和SOF2均为有毒气体,TeF4也是有毒物质,在操作过程中应加强防护,必须避免吸入和同皮肤接触。
制法2 用四氟化硒与二氧化碲反应可得四氟化碲:
TeO2+2SeF4=TeF4+2SeOF2
将两个经充分干燥的球形烧瓶连接在一起,在第一个烧瓶中放入干燥的二氧化碲,第二个烧瓶与真空管路相连接,在抽真空的同时,从储存四氟化硒的容器中蒸馏出反应所需的四氟化硒,并使之在第一个烧瓶中冷凝。然后用水浴慢慢加热二氧化碲和四氟化硒的混合物,当温度接近80℃时,反应平稳而快速地进行,二氧化碲溶解。升高温度使液体在其自身的蒸气压下发生回流,在此温度下保温5min。随后将SeF4和SeOF2蒸馏到另一烧瓶中去。最后将产品在100℃和1.33Pa下保持1h,以除去其中痕量杂质。
| TeF4 |
| tellurium(IV) fluoride |
| tellurium tetrafluoride |
| le tetrafluorure de tellure |
 CAS号63599-48-4
CAS号63599-48-4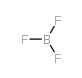 CAS号7637-07-2
CAS号7637-07-2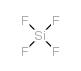 CAS号7783-61-1
CAS号7783-61-1 CAS号7446-07-3
CAS号7446-07-3 CAS号7783-80-4
CAS号7783-80-4