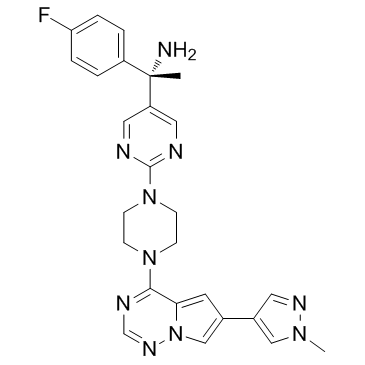
| 描述 |
Avapritinib 是一种有效的选择性外显子 17 突变型 KIT 激酶抑制剂,抑制 KIT D816V,IC50 为 0.27 nM。
|
| 相关类别 |
|
| 靶点 |
IC50: 0.27 nM (KIT D816V)[1]
|
| 体外研究 |
Avapritinib(BLU-285)已证实对KIT外显子17突变酶KIT D816V的生化体外活性(IC50 = 0.27nM)。 Avapritinib对KIT D816突变体的细胞活性通过人肥大细胞白血病细胞系HMC1.2和P815小鼠肥大细胞瘤细胞系中的自身磷酸化分别测量,IC50 = 4和22nM。在Kasumi-1细胞中,在具有KIT外显子17 N822K突变的(8; 21)阳性AML细胞系中,Avapritinib有效抑制KIT N822K突变体自身磷酸化(IC50 = 40 nM),下游信号传导以及细胞增殖(IC50 = 75 nM)[1]。
|
| 体内研究 |
体内Avapritinib(BLU-285)具有良好的耐受性,并已证实具有剂量依赖性抗肿瘤功效。每天一次10mg/kg观察到完全肿瘤生长抑制和≥75%KIT激酶抑制,在侵袭性KIT外显子17突变体驱动的P815肥大细胞瘤模型中口服给予Avapritinib作为实体肿瘤同种异体移植物以及在播散模型中疾病。通过全身荧光素酶成像(光子/秒/ mm 2)测量的疾病负荷在载体对照动物中在24天给药期间增加86倍,在股骨,骨盆和外周血中循环可检测到广泛的疾病。在实验过程中,阿糖胞苷治疗的动物的疾病进展得更慢,荧光素酶值增加15倍。引人注目的是,与载体对照和接受阿糖胞苷的动物相比,两种剂量的Avapritinib(10或30mg/kg口服,每日一次)导致整个研究中疾病负担的显着降低。 10或30mg/kg的Avapritinib导致所有具有疾病消除的动物的肿瘤消退,在研究结束时与几种动物的背景信号测量无法区分。 Avapritinib在这种体内模型中也具有良好的耐受性,并且在任一剂量下对体重均无不良影响[1]。
|
| 动物实验 |
小鼠[1] Kasumi-1 luc + AML NOG SCID小鼠股动脉注射模型用于评估Avapritinib(BLU-285)在KIT外显子17-突变的CBF-AML中的功效。在注射潜伏期后21天,给小鼠口服给予Avapritinib,每天一次以10mg / kg或30mg / kg至第45天。对照组用载体或阿糖胞苷每周一次腹膜内施用100mg / kg。
|
| 参考文献 |
[1]. Erica Evans, et al. Blu-285, a Potent and Selective Inhibitor for Hematologic Malignancies with KIT Exon 17 Mutations.Blood 2015 126:568.
|