| 描述 |
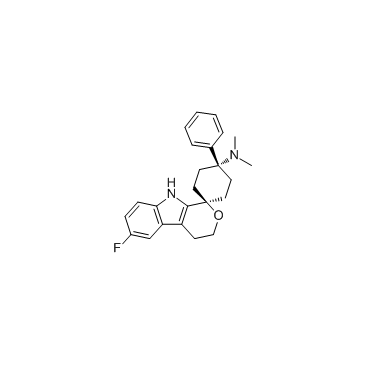
Cebranopadol 是NOP 和 opioid receptor 激动剂,作用于人NOP,MOP,KOP 和δ-阿片肽(DOP)受体,Ki/EC50 分别为 0.9 nM/13 nM,0.7 nM/1.2 nM,2.6 nM/17 nM,18 nM/110 nM。
|
| 相关类别 |
|
| 靶点 |
EC50: 13±2 nM (hNOP receptor), 1.2±0.4 nM (hMOP receptor), 17±5 nM (hKOP receptor), 110±28 nM (hDOP receptor)[1]
|
| 体外研究 |
Cebranopadol以高亲和力(亚纳摩尔至纳摩尔范围)与nociceptin/orphanin FQ肽(NOP)和阿片受体结合,对于大鼠NOP,μ-阿片肽,Ki为1±0.5 nM,2.4±1.2 nM和64±11 nM (MOP)受体和κ-阿片肽(KOP)受体,大鼠NOP,MOP和KOP受体的Ki为0.9±0.2 nM,0.7±0.3 nM和2.6±1.4 nM [1]。
|
| 体内研究 |
Cebranopadol在急性和慢性疼痛(甩尾,类风湿性关节炎,骨癌,脊神经结扎,糖尿病神经病变)的几种大鼠模型中表现出高效和有效的抗伤害性和抗过敏作用,静脉注射后ED50值为0.5-5.6μg/ kg。口服给药后25.1μg/ kg。与选择性MOP受体激动剂相比,cebranopadol在慢性神经病模型中比急性伤害性疼痛更有效。 Cebranopadol的作用持续时间很长(静脉注射12μg/ kg后最多7小时;大鼠甩尾试验中口服55μg/ kg后> 9小时)。通过用选择性NOP受体拮抗剂J-113397或阿片受体拮抗剂纳洛酮预处理,部分逆转了脊神经痛连接模型中的cebranopadol的抗过敏活性,表明NOP和阿片受体激动作用都参与了这种活性。慢性压迫性损伤模型中镇痛耐受性的发展明显延迟,与吗啡的平等剂量相比(分别于第26天与第11天完全耐受)相比。与吗啡不同,cebranopadol在剂量范围内和超过镇痛剂量范围时不会破坏运动协调和呼吸。 Cebranopadol通过其对NOP和阿片受体的激动作用的组合,在各种疼痛模型中提供高效和有效的镇痛作用,具有良好的副作用[1]。
|
| 激酶实验 |
人MOP,DOP,KOP和NOP受体结合测定在具有小麦胚芽凝集素包被的闪烁亲近测定珠的微量滴定板中进行。 [N-烯丙基-2,3-3H]纳洛酮和[酪氨酰-3,5-3H] deltorphin II,[3H] Ci-977和[leucyl-3H] nociceptin用作MOP,DOP,KOP的配体和NOP受体结合研究。用于计算Ki值的放射性配体的KD值作为补充信息提供。用于MOP,DOP和KOP受体结合研究的测定缓冲液是补充有0.052mg / mL牛血清白蛋白的50mM Tris-HCl(pH 7.4)。对于NOP受体结合研究,使用的测定缓冲液是50mM HEPES,10mM MgCl 2,1mM EDTA(pH 7.4)。 250μL/孔的最终测定体积包括1nM [3H]纳洛酮,1nM [3H] deltorphin II,1nM [3H] Ci-977或0.5nM [3H]伤害感受肽作为配体和稀释系列中的头孢拉定。将环柏那普酚用25%DMSO的水溶液稀释,得到最终的0.5%DMSO浓度,其也用作各自的载体对照。通过添加珠子(1mg珠子/孔)开始测定,其在室温下预先加载23.4μg人MOP膜,12.5μg人DOP膜,45μg人KOP膜或25.4。每250μL最终测定体积μg人NOP膜。短暂混合后,在室温下进行测定90分钟。然后将微量滴定板以500rpm离心20分钟,并通过1450 MicroBeta Trilux测量信号速率。通过非线性回归分析计算反映[3H]纳洛酮 - ,[3H] deltorphin II-,[3H] C 1-977-或[3H]痛敏肽特异性受体结合的50%置换的IC 50值。单个实验一式两份进行,并在独立实验中重复三次[1]。
|
| 动物实验 |
大鼠[1]在单次静脉内剂量160μg/ kg头孢拉定后,研究了头孢拉定在大鼠中的药代动力学特性。静脉内剂量以2mL / kg的体积推注给予,在股静脉中使用导管。通过自动血液采样系统在以下采样时间通过植入的动脉导管(动脉颈动脉)取出血样(200μL/样品):0(给药前),5,15,30,60,180,360,720,和管理后1440分钟。将血液样品离心,并分离血浆。使用经验证的液相色谱 - 串联质谱法测定头孢拉定的血浆浓度。使用50μL血浆的样品体积,该方法中的cebranopadol的定量下限为0.05 ng / mL。
|
| 参考文献 |
[1]. Linz K, et al. Cebranopadol: a novel potent analgesic nociceptin/orphanin FQ peptide and opioid receptor agonist. J Pharmacol Exp Ther. 2014 Jun;349(3):535-48. [2]. de Guglielmo G, et al. Cebranopadol Blocks the Escalation of Cocaine Intake and Conditioned Reinstatement of Cocaine Seeking in Rats. J Pharmacol Exp Ther. 2017 Sep;362(3):378-384. [3]. Satat K, et al. Evaluation of cebranopadol, a dually acting nociceptin/orphanin FQ and opioid receptor agonist in mouse models of acute, tonic, and chemotherapy-induced neuropathic pain. Inflammopharmacology. 2017 Oct 25.
|