| 描述 |
Talazoparib (BMN-673) 是高效的 PARP1/2 抑制剂,Ki 值分别为 1.2 nM 和 0.87 nM。
|
| 相关类别 |
|
| 靶点 |
PARP2:0.87 nM (Ki)
PARP1:1.2 nM (Ki)
|
| 体外研究 |
Talazoparib(BMN 673)表现出优异的效力,抑制PARP1和PARP2酶活性,分别为Ki = 1.2和0.87 nM [1]。 Talazoparib(BMN 673)具有选择性抗肿瘤细胞毒性,并且引发DNA修复生物标志物的浓度远低于早期的PARP1/2抑制剂(如Olaparib,Rucaparib和Veliparib)[2]。
|
| 体内研究 |
Talazoparib(BMN 673; 1mg/kg,口服)可口服,在口服给予单剂或与其组合后,在BRCA1突变体MX-1乳腺癌异种移植模型中显示出有利的药代动力学(PK)性质和显着的抗肿瘤功效。化疗药物如替莫唑胺和顺铂[1]。塔拉唑巴(BMN 673)易于口服生物利用,当在羧甲基纤维素中给药时,大鼠的绝对口服生物利用度超过40%。 Talazoparib的口服给药引起显着的抗肿瘤活性,由于BRCA突变或PTEN缺乏导致DNA修复缺陷的异种移植肿瘤对小鼠耐受良好的口服Talazoparib治疗非常敏感[2]。
|
| 激酶实验 |
使用PARP1测定试剂盒评估测试化合物抑制PARP1酶活性的能力。使用GraphPad Prism5软件计算IC 50值。对于PARP抑制剂Ki测定,酶测定在96孔FlashPlate中进行,其中含有0.5U PARP1酶,0.25x活化DNA,0.2μCi[3H] NAD和5μM冷NAD,终浓度为50μL,含有反应缓冲液10%甘油(v / v),25mM HEPES,12.5mM MgCl 2,50mM KCl,1mM二硫苏糖醇(DTT)和0.01%NP-40(v / v),pH 7.6。通过在有或没有抑制剂的情况下将NAD加入到PARP反应混合物中并在室温下温育1分钟来引发反应。然后向每个孔中加入50微升冰冷的20%三氯乙酸(TCA)以淬灭反应。将板密封并在室温下再摇动120分钟,然后离心。绑定到FlashPlate的放射性信号使用TopCount确定。使用来自各种底物浓度(1-100μMNAD)的Michaelis-Menten方程测定PARP1 Km。根据下式,由酶抑制曲线计算化合物Ki:Ki = IC50 / [1+(底物)/ Km]。 PARM2酶和化合物Ki的Km用相同的测定方案测定,除了在室温下将30ng的PARP2,0.25x活化的DNA,0.2μCi[3H] NAD和20μM的冷NAD用于反应30分钟[ 1]。
|
| 细胞实验 |
在单药试验中,将Capan-1细胞(BRCA2缺陷型),MX-1(BRCA1缺陷型)细胞或其他培养细胞以密度接种,允许在96孔板中线性生长10-12天(通常500-3000个细胞/孔)。将细胞在其推荐的含有不同浓度的PARP抑制剂(Veliparib,Rucaparib,Niraparib,Olaparib和Talazoparib)的生长培养基中处理10-12天(每5天用新鲜化合物更换培养基)。使用GraphPad Prism5 [1]计算IC50值。
|
| 动物实验 |
制备小鼠[1] MX-1肿瘤异种移植物。当肿瘤达到约150mm 3的平均体积时,以单剂量给予奥拉帕尼(100mg / kg),他唑巴肽(1mg / kg)或载体。在药物给药后2小时,8小时和24小时收获肿瘤并在液氮中快速冷冻。然后将肿瘤组织在PBS中在冰上匀浆并用裂解缓冲液(25mM Tris,pH 8.0,150mM NaCl,5mM EDTA,2mM EGTA,25mM NaF,2mM Na 3 VO 4,1mM Pefabloc,1%Triton X)提取。 -100,和含有1%SDS的蛋白酶抑制剂混合物)。使用PARP体内PD测定II试剂盒通过ELISA测定肿瘤裂解物中PAR的水平。
|
| 参考文献 |
[1]. Wang B, et al. Discovery and Characterization of (8S,9R)-5-Fluoro-8-(4-fluorophenyl)-9-(1-methyl-1H-1,2,4-triazol-5-yl)-2,7,8,9-tetrahydro-3H-pyrido[4,3,2-de]phthalazin-3-one (BMN 673, Talazoparib), a Novel, Highly Potent, and Orally Efficacious Poly(ADP- [2]. Shen Y, et al. BMN 673, a novel and highly potent PARP1/2 inhibitor for the treatment of human cancers with DNA repair deficiency.Clin Cancer Res. 2013 Sep 15;19(18):5003-15.
|



![5-氟-8-(4-氟苯基)-2,7,8,9-四氢-9-(1-甲基-1H-1,2,4-三唑-5-基)-3H-吡啶并[4,3,2-DE]酞嗪-3-酮结构式](https://image.chemsrc.com/caspic/203/1207454-56-5.png) CAS号1207454-56-5
CAS号1207454-56-5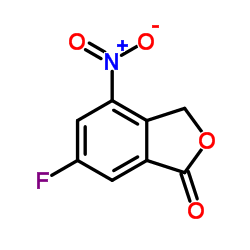 CAS号1207453-90-4
CAS号1207453-90-4 CAS号1322616-34-1
CAS号1322616-34-1 CAS号459-57-4
CAS号459-57-4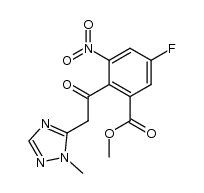 CAS号1322879-81-1
CAS号1322879-81-1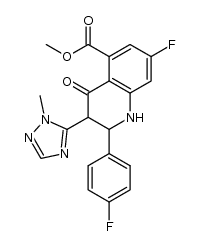 CAS号1322616-36-3
CAS号1322616-36-3 CAS号1322616-40-9
CAS号1322616-40-9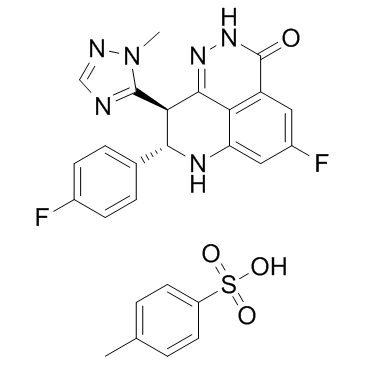 CAS号1373431-65-2
CAS号1373431-65-2
