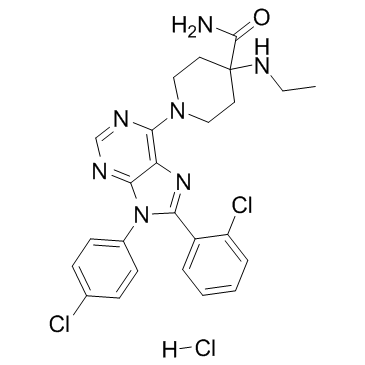
| 描述 |
Otenabant (CP945598)盐酸盐是CB1受体高亲和性拮抗剂,Ki为0.7 nM。
|
| 相关类别 |
|
| 靶点 |
Ki: 0.7 nM (CB1)
|
| 体外研究 |
对于人CB2受体,Otenabant HCl与7.6μM的Ki具有低亲和力[1]。 Otenabant HCl抑制CB1受体,具有中度未结合的微粒体清除率,低hERG亲和力和足够的CNS渗透[2]。
|
| 体内研究 |
Otenabant急剧刺激大鼠的能量消耗并降低呼吸商,表明代谢转换为脂肪氧化增加。在饮食诱导的肥胖小鼠的10天减重研究中,Otenabant(10 mg/kg,po)促进了9%的载体调整体重减轻[1]。在给予合成的CB1受体激动剂CP-55940后,Otenabant HCl逆转了四种大麻素激动剂介导的行为(运动活动,体温过低,镇痛和僵住症)。 Otenabant HCl在啮齿动物的急性食物摄入模型中表现出剂量依赖性的厌食活性,并增加能量消耗和脂肪氧化[2]。
|
| 激酶实验 |
从用人CB-1受体cDNA稳定转染的CHOK1细胞制备膜。 GTPγ[35S]结合分析以96孔FlashPlate形式进行,一式两份,使用100pMGTPγ[35S]和10μg每孔膜在由50 mM Tris HCl,pH 7.4,3 mM MgCl2,pH 7.4,10组成的分析缓冲液中进行mM MgCl2,20 mM EGTA,100 mM NaCl,30μMGDP,0.1%牛血清白蛋白和以下蛋白酶抑制剂:100μg/ mL杆菌肽,100μg/ mL苯甲脒,5μg/ mL抑肽酶,5μg/ mL亮肽素。然后将测定混合物与递增浓度的拮抗剂(10-10M至10-5M)一起温育10分钟,并用大麻素激动剂CP-55,940(10μM)攻击。测定在30℃下进行1小时。然后将FlashPlates以2000g离心10分钟。然后使用Wallac Microbeta定量刺激GTPγ[35S]结合。 EC50计算使用GraphPad的Prism完成。在不存在激动剂的情况下测量反向激动。
|
| 动物实验 |
选择14周龄的C57 / Bl6 / 6J小鼠,其在高脂肪饮食(来自脂肪的45%kcal)下维持6周,用于DIO减重研究。动物体重与年龄匹配的饲喂对照动物的平均体重至少相差五个标准偏差。小鼠是单独饲养的。所有动物的平均起始重量为38.9±0.5g。在第0天,将小鼠随机分配至治疗组(每组n = 10)。每天给予小鼠载体或10mg / kg(po)CP-945,598,持续10天,在12小时黑暗循环开始前约30分钟开始。每日记录BW和食物摄入量。针对每日和累积FI和累积BW测量计算方差分析和均值比较。 P <0.05被认为具有统计学意义。
|
| 参考文献 |
[1]. John R. Hadcock, et al. In vitro and in vivo pharmacology of CP-945,598, a potent and selective cannabinoid CB1 receptor antagonist for the management of obesity. Biochemical and Biophysical Research Communications, 2010; 394;366-371. [2]. Griffith DA, et al. Discovery of 1-[9-(4-chlorophenyl) -8-(2-chlorophenyl)- 9H-purin-6-yl] -4-ethylaminopiperidine-4-carboxylic acid amide hydrochloride (CP-945,598), a novel, potent, and selective cannabinoid type 1 receptor antagonist. JMedChem. 2009 ;5
|