巴佛洛霉素A1
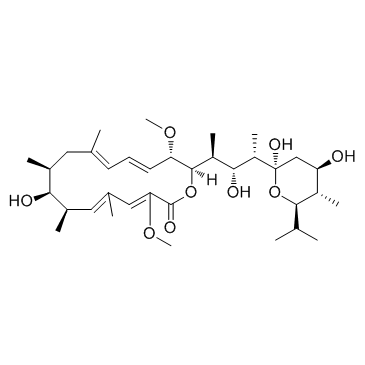
巴佛洛霉素A1结构式

|
常用名 | 巴佛洛霉素A1 | 英文名 | Bafilomycin A1 |
|---|---|---|---|---|
| CAS号 | 88899-55-2 | 分子量 | 622.830 | |
| 密度 | 1.1±0.1 g/cm3 | 沸点 | 770.1±60.0 °C at 760 mmHg | |
| 分子式 | C35H58O9 | 熔点 | N/A | |
| MSDS | 中文版 美版 | 闪点 | 232.2±26.4 °C |
巴佛洛霉素A1用途Bafilomycin A1,一种从链霉菌属物种中分离的大环内酯类抗生素,是特异的 vacuolar-type H+ ATPase 抑制剂。 |
| 中文名 | 巴佛洛霉素A1 |
|---|---|
| 英文名 | bafilomycin A1 |
| 中文别名 | 维生素 D2 |
| 英文别名 | 更多 |
| 描述 | Bafilomycin A1,一种从链霉菌属物种中分离的大环内酯类抗生素,是特异的 vacuolar-type H+ ATPase 抑制剂。 |
|---|---|
| 相关类别 | |
| 靶点实验 |
H+ ATPase[1] |
| 体外研究 | 低浓度(1nM)的巴弗洛霉素A1有效且特异性地抑制并杀死小儿B细胞急性淋巴细胞白血病细胞。它针对自噬途径的早期和晚期,线粒体并诱导不依赖caspase的细胞凋亡。巴弗洛霉素A1诱导Beclin 1与Bcl-2的结合,进一步抑制自噬并促进凋亡细胞死亡[1]。 BEL-7402肝细胞癌和HO-8910卵巢癌细胞系的生长受到阻滞,并且巴弗洛霉素A1抑制了转移潜能。透射电子显微镜和capsase-3和-9的测定表明,巴弗洛霉素A1诱导细胞凋亡[2]。巴弗洛霉素A1剂量依赖性地抑制多种培养细胞的生长,包括金仓鼠胚胎和NIH-3T3成纤维细胞,无论它们是否被转化,以及PC12和HeLa细胞。巴弗洛霉素A1抑制细胞生长的IC50范围为10至50 nM [3]。 |
| 体内研究 | 用低剂量巴弗洛霉素A1(0.1mg/kg)慢性治疗略微抑制肿瘤体积,但最终肿瘤体积与对照没有显着差异。然而,与对照组相比,高剂量巴弗洛霉素A1(1 mg/kg)的慢性治疗在21天后显着抑制肿瘤生长[4]。 |
| 细胞实验 | 使用0.05%胰蛋白酶收获细胞并悬浮于含有10%FCS的培养基中,并将200μL悬浮液加入96孔板的每个孔中。将细胞培养20小时以进行粘附。将巴弗洛霉素A1以200,400和800nM的终浓度加入孔中,一式三份。在24,48和72小时,向细胞中加入20μlWST-1。在37℃下孵育4小时后,读取平板以使用分光光度计[2]确定435nm处的光密度(OD)和675nm参比。 |
| 动物实验 | 小鼠:将携带肿瘤的小鼠随机分成三个实验组:低剂量巴弗洛霉素A1(0.1mg / kg每天)治疗组(n = 5),高剂量巴弗洛霉素A1(1mg / kg每天) - 治疗组(n = 5)和对照组(n = 5)。测量肿瘤大小并计算肿瘤体积倍增时间[2]。 |
| 参考文献 |
| 密度 | 1.1±0.1 g/cm3 |
|---|---|
| 沸点 | 770.1±60.0 °C at 760 mmHg |
| 分子式 | C35H58O9 |
| 分子量 | 622.830 |
| 闪点 | 232.2±26.4 °C |
| 精确质量 | 622.408081 |
| PSA | 134.91000 |
| LogP | 3.88 |
| InChIKey | XDHNQDDQEHDUTM-PXKWMJKESA-N |
| SMILES | COC1=CC(C)=CC(C)C(O)C(C)CC(C)=CC=CC(OC)C(C(C)C(O)C(C)C2(O)CC(O)C(C)C(C(C)C)O2)OC1=O |
| 蒸汽压 | 0.0±6.0 mmHg at 25°C |
| 折射率 | 1.535 |
| 储存条件 | 2-8°C冷藏 |
| 分子结构 | 1、 摩尔折射率:171.94 2、 摩尔体积(m3/mol):552.3 3、 等张比容(90.2K):1438.8 4、 表面张力(dyne/cm):46.0 5、 极化率(10-24cm3):68.16 |
| 计算化学 | 1、 疏水参数计算参考值(XlogP):6 2、 氢键供体数量:4 3、 氢键受体数量:9 4、 可旋转化学键数量:7 5、 互变异构体数量: 6、 拓扑分子极性表面积(TPSA):135 7、 重原子数量:44 8、 表面电荷:0 9、 复杂度:1060 10、同位素原子数量:0 11、确定原子立构中心数量:12 12、不确定原子立构中心数量:0 13、确定化学键立构中心数量:4 14、不确定化学键立构中心数量:0 15、共价键单元数量:1 |
| 个人防护装备 | dust mask type N95 (US);Eyeshields;Gloves |
|---|---|
| 危害码 (欧洲) | Xi: Irritant; |
| 风险声明 (欧洲) | R36/37/38 |
| 安全声明 (欧洲) | 26-36 |
| 危险品运输编码 | UN 3172 |
| WGK德国 | 3 |
| 包装等级 | III |
| 危险类别 | 6.1(b) |
| 巴佛洛霉素A1上游产品 4 | |
|---|---|
| 巴佛洛霉素A1下游产品 0 | |
|
SUMO1 promotes Aβ production via the modulation of autophagy.
Autophagy 11(1) , 100-12, (2015) Autophagy is one of the main mechanisms in the pathophysiology of neurodegenerative disease. The accumulation of autophagic vacuoles (AVs) in affected neurons is responsible for amyloid-β (Aβ) product... |
|
|
GA binding protein augments autophagy via transcriptional activation of BECN1-PIK3C3 complex genes.
Autophagy 10(9) , 1622-36, (2014) Macroautophagy is a vesicular catabolic trafficking pathway that is thought to protect cells from diverse stressors and to promote longevity. Recent studies have revealed that transcription factors pl... |
|
|
Autophagy facilitates secretion and protects against degeneration of the Harderian gland.
Autophagy 11(2) , 298-313, (2015) The epithelial derived Harderian gland consists of 2 types of secretory cells. The more numerous type A cells are responsible for the secretion of lipid droplets, while type B cells produce dark granu... |
| (5R)-2,4-Dideoxy-1-C-{(2S,3R,4S)-3-hydroxy-4-[(2R,3S,4E,6E,9S,10S,11R,12E,14Z)-10-hydroxy-3,15-dimethoxy-7,9,11,13-tetramethyl-16-oxooxacyclohexadeca-4,6,12,14-tetraen-2-yl]pentan-2-yl}-5-isopropyl-4-methyl-α-D-threo-pentopyranose |
| 21-O-de(3-carboxy-1-oxo-2-propenyl)-2-demethyl-2-methoxy-24-methyl-hygrolidin |
| bafilomycin A |
| MFCD06795130 |
| (5R)-2,4-Dideoxy-1-C-{(2S,3R,4S)-3-hydroxy-4-[(2R,3S,4E,6E,9S,10S,11R,12E,14Z)-10-hydroxy-3,15-dimethoxy-7,9,11,13-tetramethyl-16-oxooxacyclohexadeca-4,6,12,14-tetraen-2-yl]-2-pentanyl}-5-isopropyl-4- ;methyl-α-D-threo-pentopyranose |
| BafilomycinA1fromStreptomycesgriseus |
| (5R)-2,4-Dideoxy-1-C-{(2S,3R,4S)-3-hydroxy-4-[(3S,4Z,6Z,9S,10S,11R,12Z,14E)-10-hydroxy-3,15-dimethoxy-7,9,11,13-tetramethyl-16-oxooxacyclohexadeca-4,6,12,14-tetraen-2-yl]-2-pentanyl}-5-isopropyl-4-met ;hyl-α-D-threo-pentopyranose |
| BAFILOMYCIN A1 |
| bafilomycin |
| (3Z,5E,7R,8S,9S,11E,13E,15S,16R)-8-Hydroxy-16-[(1S,2R,3S)-2-hydroxy-1-Methyl-3-[(2R,4R,5S,6R)-tetrahydro-2,4-dihydroxy-5-Methyl-6-(1-Methylethyl)-2H-pyran-2-yl]butyl]-3,15-diMethoxy-5,7,9,11-tetraMethyloxacyclohexadeca-3,5,11,13-tetraen-2-o |
| (3Z,5E,7R,8S,9S,11E,13E,15S,16R)-8-Hydroxy-16-((1S,2R,3S)-2-hydroxy-1-methyl-3-((2R,4R,5S,6R)-tetrahydro-2,4-dihydroxy-5 |
| Bafilomycin A1 from Streptomycesgriseus,10 ug |

 CAS号243468-81-7
CAS号243468-81-7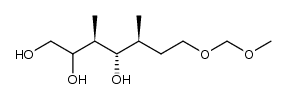 CAS号381246-92-0
CAS号381246-92-0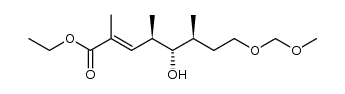 CAS号381247-15-0
CAS号381247-15-0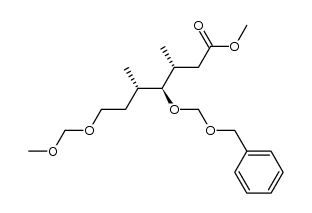 CAS号381246-91-9
CAS号381246-91-9






